স্টার্চের শারীরিক বৈশিষ্ট্য। মাড়
রসায়ন সবচেয়ে অনন্য এবং আকর্ষণীয় বিজ্ঞানযার সাহায্যে জীবনে আমাদের চারপাশে ঘটে যাওয়া অনেক প্রক্রিয়া ব্যাখ্যা করা যায়। উদাহরণ স্বরূপ, কেন লোহা ধীরে ধীরে মরিচা ধরে, এবং এছাড়াও কেন একটি অ্যালুমিনিয়াম চামচ এত তাড়াতাড়ি গরম হয়ে যায় গরম চা. রসায়ন আমাদেরকে সর্বত্র ঘিরে রেখেছে: এসিটিক এসিডবা ভিনেগার, বা সুপরিচিত লবণ, সেইসাথে আয়োডিন, ব্লিচ, অ্যালকোহল এবং আরও অনেকের মতো পদার্থ। তবে রসায়নে এমন একটি পদার্থ রয়েছে যা সবার কাছে পরিচিত এবং এটিকে বলা হয় রাসায়নিক পদ্ধতিতেও পাওয়া যায়, তবে বেশিরভাগ ক্ষেত্রে এটি আলু থেকে বের করা হয়। রাসায়নিক সূত্র থেকে শুরু করে এবং এর বৈশিষ্ট্যগুলির সাথে শেষ হওয়া এবং কীভাবে স্টার্চকে স্বীকৃত করা যায় তার সাথে সংযুক্ত সবকিছুকে ঘনিষ্ঠভাবে দেখে নেওয়া যাক।
স্টার্চ, যার সূত্রটি নিম্নরূপ: C6H10O5 এর একটি সংখ্যা রয়েছে আকর্ষণীয় বৈশিষ্ট্য. উদাহরণস্বরূপ, প্রত্যেকের প্রিয় জেলি জমে যায় কারণ এতে যথেষ্ট পরিমাণে থাকে অনেকমাড়. স্টার্চ দেখতে সাধারণ পাউডারের মতো, কোনো গন্ধ নেই, ব্যবহারিকভাবে স্বাদহীন এবং সবচেয়ে মজার বিষয় হল এটি একটু ঘষে দিলেই এটি ক্রেক হয়ে যায়। স্টার্চের অণুগুলি বেশ বড় হওয়ার কারণেই এই স্টার্চ।
সাধারণভাবে, স্টার্চ, এর সূত্র এবং কিছু বৈশিষ্ট্য তুলনামূলকভাবে সম্প্রতি আবিষ্কৃত হয়েছে। স্টার্চ গাছপালা দ্বারা উত্পাদিত হয়, শুধুমাত্র আলু নয়, কিন্তু অন্যান্য, যেমন ভুট্টা এবং গম। আলুতে মাত্র বিশ শতাংশ স্টার্চ থাকে, যেখানে গম এবং ভুট্টার দানায় সত্তর শতাংশের বেশি স্টার্চ থাকে। স্টার্চ গঠিত হয় যখন কার্বন ডাই অক্সাইডের ছয়টি অণু এবং পানির পাঁচটি অণু সালোকসংশ্লেষণের সময় একত্রিত হয়, তারপরে স্টার্চের একটি অণু এবং অক্সিজেনের ছয়টি অণু গঠিত হয়।
যেমন উপরে বর্ণিত, রাসায়নিক সূত্রস্টার্চে ছয়টি কার্বন পরমাণু, দশটি হাইড্রোজেন পরমাণু এবং পাঁচটি অক্সিজেন পরমাণু থাকে। এটি ইঙ্গিত করে যে স্টার্চের অণুটি খুব বড়, তবে এটি একেবারে জৈব উত্সের, অর্থাৎ এটি জৈব নামক রসায়নের শাখার অন্তর্গত। এই পদার্থটিকে জটিল বলে মনে করা হয় এবং এটি পলিস্যাকারাইডের বিভাগের অন্তর্গত, যদিও এটি চিনি বা অনুরূপ পদার্থ নয়। স্টার্চ হিসাবে শ্রেণীবদ্ধ করা হয় জৈবপদার্থঅক্সিজেন ধারণ করে, বা অন্যথায় - অক্সিজেনযুক্ত জৈব পদার্থ।
স্টার্চকে জটিল হিসাবেও বিবেচনা করা হয়, কারণ এটিকে লিখিতভাবে প্রকাশ করা অসম্ভব। আমরা কেবল বলতে পারি যে স্টার্চ, এর সূত্র আরও সুনির্দিষ্ট হতে, এতে বেশ কয়েকটি OH গ্রুপ রয়েছে, যার প্রতিটি একটি কার্বন পরমাণুর সাথে সংযুক্ত। অনেকে OH গ্রুপের কথা শুনে এই অণুটিকে কিছু অ্যালকোহলের অণুর সাথে বিভ্রান্ত করে, কিন্তু আসলে C6H10O5 অণুতে স্টার্চ থাকে।
আপনি যদি স্টার্চ চিনতে চান, তবে আপনাকে এটি নিয়ে বেশি বা দীর্ঘ সময়ের জন্য ভাবতে হবে না। একটি পদার্থে স্টার্চের উপস্থিতির একটি গুণগত প্রতিক্রিয়া নিম্নরূপ: আয়োডিনের দ্রবণের কয়েক ফোঁটা একটি টেস্ট টিউবে ফেলে দিন। যদি সমাধানটি অবিলম্বে স্কিমযোগ্য হয়ে যায়, তাহলে আপনি নিঃসন্দেহে টেস্টটিউব সাইন ইন করতে পারেন এবং নিশ্চিত হন যে এতে স্টার্চ রয়েছে। আপনি যদি পরীক্ষামূলক অবস্থার অধীনে এই প্রতিক্রিয়াটি পরীক্ষা করতে চান তবে একটি ছোট আলু নিন, এটি কেটে নিন এবং তারপরে একটি পিপেটের সাথে কয়েক ফোঁটা আয়োডিন (যে ধরনের ক্ষত পরিষ্কার করার জন্য ফার্মেসীগুলিতে বিক্রি হয়) সাবধানে ফেলে দিন। কিছু সময়ের পরে, আপনি স্টার্চের একটি গুণগত প্রতিক্রিয়ার সুস্পষ্ট প্রভাব দেখতে পাবেন: আয়োডিন যে জায়গায় ছিল সেখানে আলু ধীরে ধীরে নীল হতে শুরু করবে।
সুতরাং, এখন আপনি স্টার্চ সম্পর্কে অনেক কিছু জানেন (স্টার্চ কী, সূত্র, বৈশিষ্ট্য এবং গুণগত প্রতিক্রিয়া)। অবশ্যই, উপরের সমস্ত তথ্য সম্পূর্ণ নয়, তবে আপনি যদি পরীক্ষার জন্য প্রস্তুতি নিচ্ছেন জৈব রসায়ন, সে অবশ্যই আপনাকে সাহায্য করবে।
স্টার্চের গঠন।
স্টার্চে 2টি পলিস্যাকারাইড থাকে - অ্যামাইলোজ এবং অ্যামাইলোপেকটিন, গ্লুকোজের অবশিষ্টাংশ দ্বারা গঠিত। এটা পরীক্ষামূলকভাবে প্রমাণিত হয়েছে যে স্টার্চের রাসায়নিক সূত্র হল [C 6 (H 2 O) 5]n।
এটি প্রতিষ্ঠিত হয়েছে যে স্টার্চ কেবল রৈখিক অণুই নয়, শাখাযুক্ত কাঠামোর অণুগুলির মধ্যেও রয়েছে। এটি স্টার্চের দানাদার গঠন ব্যাখ্যা করে।
প্রকৃতিতে থাকা। স্টার্চ প্রাপ্তি।
শস্য আকারে জমা হয়, প্রধানত বীজ, বাল্ব, কন্দের কোষে, সেইসাথে পাতা এবং কান্ডে। স্টার্চ একটি সাদা পাউডার, অদ্রবণীয় ঠান্ডা পানি. ভিতরে গরম পানিএটি ফুলে যায় এবং একটি পেস্ট তৈরি করে যা প্রায়শই আলু থেকে পাওয়া যায়। এটি করার জন্য, আলু চূর্ণ করা হয়, জল দিয়ে ধুয়ে এবং বড় পাত্রে পাম্প করা হয় যেখানে বসতি ঘটে। ফলস্বরূপ স্টার্চ আবার জল দিয়ে ধুয়ে, উষ্ণ বাতাসের স্রোতে বসানো এবং শুকানো হয়।
স্টার্চ প্রয়োগ।
স্টার্চ হল সবচেয়ে গুরুত্বপূর্ণ খাদ্যপণ্যের প্রধান অংশ: ময়দা (75 - 80%), আলু (25%), সাগো ইত্যাদি। শক্তির মান প্রায় 16.8 kJ/g।
এটি একটি মূল্যবান পুষ্টিকর পণ্য। এর শোষণের সুবিধার্থে, স্টার্চযুক্ত খাবারগুলি উচ্চ তাপমাত্রার সংস্পর্শে আসে, অর্থাৎ, আলু সিদ্ধ করা হয়, রুটি বেক করা হয়। এই অবস্থার অধীনে, স্টার্চের আংশিক হাইড্রোলাইসিস ঘটে এবং ডেক্সট্রিন, পানিতে দ্রবণীয়, গঠিত হয়। পাচনতন্ত্রের ডেক্সট্রিনগুলি গ্লুকোজে আরও হাইড্রোলাইসিস করে, যা শরীর দ্বারা শোষিত হয়। অতিরিক্ত গ্লুকোজ গ্লাইকোজেনে (প্রাণী স্টার্চ) রূপান্তরিত হয়। গ্লাইকোজেনের গঠন স্টার্চের মতোই, [C 6 (H 2 O) 5 ]n., কিন্তু এর অণুগুলি আরও শাখাযুক্ত। লিভারে বিশেষ করে প্রচুর গ্লাইকোজেন থাকে (10% পর্যন্ত)। শরীরে, গ্লাইকোজেন একটি সংরক্ষিত পদার্থ যা কোষে খাওয়ার সাথে সাথে গ্লুকোজে রূপান্তরিত হয়।
শিল্পে, স্টার্চ হাইড্রোলাইসিস দ্বারা গুড় এবং গ্লুকোজে রূপান্তরিত হয়। এটি করার জন্য, এটি পাতলা সালফিউরিক অ্যাসিড দিয়ে উত্তপ্ত হয়, যার অতিরিক্ত তারপর চক দিয়ে নিরপেক্ষ করা হয়।
ক্যালসিয়াম সালফেটের ফলস্বরূপ অবক্ষয় ফিল্টার করা হয়, দ্রবণটি বাষ্পীভূত হয় এবং গ্লুকোজ বিচ্ছিন্ন হয়। স্টার্চ হাইড্রোলাইসিস সম্পূর্ণ না হলে, ডেক্সট্রিন এবং গ্লুকোজের মিশ্রণ তৈরি হয় - গুড়, যা মিষ্টান্ন শিল্পে ব্যবহৃত হয়। স্টার্চ থেকে প্রাপ্ত ডেক্সট্রিন কাপড়ে নকশা প্রয়োগ করার সময় পেইন্ট ঘন করতে আঠা হিসাবে ব্যবহার করা হয়।
স্টার্চ স্টার্চিং লিনেন ব্যবহার করা হয়। একটি গরম লোহার অধীনে, স্টার্চ আংশিকভাবে হাইড্রোলাইজ করা হয় এবং ডেক্সট্রিনে রূপান্তরিত হয়। পরেরটি ফ্যাব্রিকের উপর একটি ঘন ফিল্ম তৈরি করে, যা ফ্যাব্রিকে চকচকে যোগ করে এবং এটিকে ময়লা থেকে রক্ষা করে। স্টার্চ এবং এর ডেরিভেটিভগুলি কাগজ, টেক্সটাইল, ফাউন্ড্রি এবং অন্যান্য শিল্পের পাশাপাশি ফার্মাসিউটিক্যাল শিল্পেও ব্যবহৃত হয়।
সেলুলোজের আণবিক সূত্র হল [C 6 (H 2 O) 5]n, স্টার্চের মতো।
সেলুলোজও একটি প্রাকৃতিক পলিমার। এর ম্যাক্রোমোলিকিউল গ্লুকোজ অণুর অনেক অবশিষ্টাংশ নিয়ে গঠিত। প্রশ্ন উঠতে পারে: কেন স্টার্চ এবং সেলুলোজ - একই আণবিক সূত্র সহ পদার্থ - বিভিন্ন বৈশিষ্ট্য রয়েছে?
সিন্থেটিক পলিমার বিবেচনা করার সময়, আমরা ইতিমধ্যে খুঁজে পেয়েছি যে তাদের বৈশিষ্ট্য প্রাথমিক ইউনিটের সংখ্যা এবং তাদের গঠনের উপর নির্ভর করে। একই পরিস্থিতি প্রাকৃতিক পলিমারের ক্ষেত্রে প্রযোজ্য। দেখা যাচ্ছে যে সেলুলোজের পলিমারাইজেশনের ডিগ্রি স্টার্চের চেয়ে অনেক বেশি। উপরন্তু, এই প্রাকৃতিক পলিমারগুলির কাঠামোর তুলনা করে, এটি প্রতিষ্ঠিত হয়েছিল যে সেলুলোজ ম্যাক্রোমোলিকিউলস, স্টার্চের বিপরীতে, (-গ্লুকোজ) অণুর অবশিষ্টাংশ নিয়ে গঠিত এবং শুধুমাত্র একটি রৈখিক কাঠামো রয়েছে এবং ফাইবার গঠন করে। শণ, তুলা, শণ)।
একটি গ্লুকোজ অণুর প্রতিটি অবশিষ্টাংশে তিনটি হাইড্রক্সিল গ্রুপ থাকে। সেলুলোজ একটি তন্তুযুক্ত পদার্থ। এটি গলে না এবং বাষ্পের অবস্থায় যায় না: যখন আনুমানিক 350 ডিগ্রি সেলসিয়াস তাপমাত্রায় উত্তপ্ত হয়, সেলুলোজ পচে যায় - এটি অক্ষর তৈরি করে। সেলুলোজ পানি বা অন্যান্য অজৈব এবং জৈব দ্রাবকগুলিতে অদ্রবণীয়।
সেলুলোজের জন্য দ্রাবক হল শোয়েটজারের বিকারক - অ্যামোনিয়ার সাথে কপার (II) হাইড্রক্সাইডের একটি দ্রবণ, যার সাথে এটি একই সাথে যোগাযোগ করে। ঘনীভূত অ্যাসিড (সালফিউরিক, ফসফরিক) এবং জিঙ্ক ক্লোরাইডের ঘনীভূত দ্রবণও সেলুলোজ দ্রবীভূত করে, তবে এই ক্ষেত্রে এর আংশিক পচন (হাইড্রোলাইসিস) ঘটে, আণবিক ওজন হ্রাসের সাথে।
সেলুলোজ এর প্রয়োগ.
সেলুলোজ খুব প্রাচীন কাল থেকেই মানুষ ব্যবহার করে আসছে। প্রথমদিকে, কাঠ জ্বালানী হিসাবে ব্যবহৃত হত এবং নির্মান সামগ্রী; তারপর তুলা, শণ এবং অন্যান্য ফাইবার টেক্সটাইল কাঁচামাল হিসাবে ব্যবহার করা শুরু করে। কাঠের রাসায়নিক প্রক্রিয়াকরণের প্রথম শিল্প পদ্ধতিগুলি কাগজ শিল্পের বিকাশের সাথে যুক্ত হয়েছিল। কাগজ হল ফাইবার ফাইবারগুলির একটি পাতলা স্তর, যা যান্ত্রিক শক্তি, একটি মসৃণ পৃষ্ঠ তৈরি করতে এবং কালিকে রক্তপাত থেকে রোধ করতে সংকুচিত এবং আঠালো। প্রাথমিকভাবে, কাগজ তৈরির জন্য, উদ্ভিদের উপকরণ ব্যবহার করা হত, যা থেকে বিশুদ্ধভাবে যান্ত্রিকভাবে প্রয়োজনীয় তন্তু পাওয়া সম্ভব ছিল, ধানের ডাঁটা (তথাকথিত চালের কাগজ), তুলা এবং জীর্ণ কাপড়ও ব্যবহার করা হত। যাইহোক, বই মুদ্রণের বিকাশের সাথে সাথে, তালিকাভুক্ত কাঁচামালের উত্সগুলি কাগজের ক্রমবর্ধমান চাহিদা মেটাতে অপর্যাপ্ত হয়ে ওঠে। বিশেষ করে সংবাদপত্র ছাপানোর জন্য প্রচুর কাগজ খরচ হয় এবং নিউজপ্রিন্ট পেপারের গুণমানের (সাদা, শক্তি, স্থায়িত্ব) বিষয়টি কোন ব্যাপার নয়। কাঠে প্রায় 50% ফাইবার থাকে জেনে তারা কাগজের সজ্জায় মাটির কাঠ যোগ করতে শুরু করে। এই জাতীয় কাগজ ভঙ্গুর এবং দ্রুত হলুদ হয়ে যায় (বিশেষত আলোতে)। কাগজ সজ্জা, রাসায়নিক বিভিন্ন পদ্ধতি কাঠ additives গুণমান উন্নত করতে কাঠ প্রক্রিয়াকরণ, এটি থেকে কমবেশি বিশুদ্ধ সেলুলোজ প্রাপ্ত করা সম্ভব করে, সহগামী পদার্থ থেকে মুক্ত - লিগনিন, রজন এবং অন্যান্য। সেলুলোজ বিচ্ছিন্ন করার জন্য বেশ কয়েকটি পদ্ধতি প্রস্তাব করা হয়েছে সালফাইট পদ্ধতি অনুসারে, চূর্ণ করা কাঠকে ক্যালসিয়াম হাইড্রোসালফাইটের চাপে "রান্না" করা হয়। এই ক্ষেত্রে, সহগামী পদার্থ দ্রবীভূত হয়, এবং অমেধ্য থেকে মুক্ত সেলুলোজ পরিস্রাবণ দ্বারা পৃথক করা হয়। ফলে সালফাইট লিকার কাগজ উৎপাদনে অপচয় হয়। যাইহোক, তারা অন্যান্য পদার্থের সাথে, গাঁজন করতে সক্ষম মনোস্যাকারাইড ধারণ করার কারণে, এগুলি ইথাইল অ্যালকোহল (তথাকথিত হাইড্রোলাইটিক অ্যালকোহল) তৈরির জন্য কাঁচামাল হিসাবে ব্যবহৃত হয়। সেলুলোজ ভিসকস, অ্যাসিটেট, তামা-অ্যামোনিয়াম ফাইবার উত্পাদন করতে ব্যবহৃত হয়।
কার্বোহাইড্রেট হিসাবে শ্রেণীবদ্ধ করা হয় কোন পদার্থ?
কিভাবে কার্বোহাইড্রেট শ্রেণীবদ্ধ করা যেতে পারে?
কার্বোহাইড্রেট কোথায় পাওয়া যায়?
কি জৈবিক ভূমিকাকার্বোহাইড্রেট?
যা রাসায়নিক বৈশিষ্ট্যগ্লুকোজ এর বৈশিষ্ট্য?
স্টার্চ এবং সেলুলোজ এর বৈশিষ্ট্য তুলনা করুন।
স্টার্চ কোথায় ব্যবহার করা হয়?
গ্লুকোজ গাঁজন বিক্রিয়া কোথায় ব্যবহৃত হয়?
লেকচার নং 29: আমিনস। যৌগ. গঠন। বৈশিষ্ট্য.
আমিনস- জৈব যৌগগুলি যা অ্যামোনিয়ার ডেরিভেটিভ হিসাবে বিবেচিত হয়, যেখানে হাইড্রোজেন পরমাণু (এক, দুই বা তিনটি) হাইড্রোকার্বন র্যাডিকাল দ্বারা প্রতিস্থাপিত হয়। কতগুলি হাইড্রোজেন পরমাণু র্যাডিক্যাল দ্বারা প্রতিস্থাপিত হয় তার উপর নির্ভর করে অ্যামাইনগুলিকে প্রাথমিক, মাধ্যমিক, তৃতীয় ভাগে ভাগ করা হয়:
প্রাথমিক মাধ্যমিক তৃতীয়
amines amines amines
র্যাডিকালগুলির প্রকৃতির উপর নির্ভর করে, অ্যামাইনগুলি আলিফ্যাটিক (স্যাচুরেটেড এবং অসম্পৃক্ত), অ্যালিসাইক্লিক, সুগন্ধযুক্ত বা মিশ্র হতে পারে।
স্যাচুরেটেড অ্যালিফ্যাটিক অ্যামিনের সাধারণ সূত্র সঙ্গে n এন 2n+3 এন.
গঠন।অ্যামাইন অণুতে নাইট্রোজেন পরমাণু sp 3 হাইব্রিডাইজেশন অবস্থায় রয়েছে। চারটি হাইব্রিড অরবিটালের মধ্যে তিনটি N-C এবং N-H σ বন্ধন গঠনে জড়িত; অ্যামাইনগুলি সাধারণত হাইড্রোকার্বন র্যাডিকেলগুলি তালিকাভুক্ত করে (বর্ণানুক্রমিক ক্রমে) এবং প্রত্যয় যোগ করে নামকরণ করা হয় -মাইন।
ইলেকট্রন-দানকারী বিকল্প (স্যাচুরেটেড হাইড্রোকার্বন র্যাডিকেল) নাইট্রোজেন পরমাণুর ইলেক্ট্রন ঘনত্ব বাড়ায় এবং অ্যামাইনগুলির মৌলিক বৈশিষ্ট্যগুলিকে উন্নত করে, তাই সেকেন্ডারি অ্যামাইনগুলি প্রাথমিকগুলির তুলনায় শক্তিশালী ঘাঁটি, যেহেতু দুটি র্যাডিকেল নাইট্রোজেন পরমাণুতে একটির চেয়ে বেশি ইলেক্ট্রন ঘনত্ব তৈরি করে। টারশিয়ারি অ্যামাইনগুলিতে, স্থানিক ফ্যাক্টর একটি গুরুত্বপূর্ণ ভূমিকা পালন করে: তিনটি র্যাডিকেল নাইট্রোজেন পরমাণুর ইলেক্ট্রন জোড়াকে ব্লক করে এবং অন্যান্য অণুর সাথে এর মিথস্ক্রিয়াকে বাধা দেয়, তাই টারশিয়ারি অ্যামাইনগুলির মৌলিকতা প্রাথমিক বা মাধ্যমিকগুলির তুলনায় কম।
অ্যামাইনের আইসোমেরিজম কার্বন কঙ্কালের গঠন এবং অ্যামিনো গ্রুপের অবস্থানের সাথে যুক্ত:
বিউটিলামাইন সেকেন্ড-বুটিলামাইন আইসোবিউটিলামাইন
(butanamine-1) (butanamine-2) (2-methylpropanamine-1)
উপরন্তু, একই সংখ্যক কার্বন পরমাণু সমন্বিত প্রাথমিক, মাধ্যমিক এবং তৃতীয় অ্যামাইন একে অপরের সাথে আইসোমেরিক, উদাহরণস্বরূপ:
CH 3 -CH 2 -NH 2 CH 3 -NH-CH 3
ethylamine dimethylamine
নামকরণ।
C 2 H 5 -NH 2 CH 3 -NH-C 2 H 5 (CH 3) 3 N
ethylamine methylethylamine trimethylamine
অন্য একটি সিস্টেম অনুসারে, প্রাথমিক অ্যামাইনগুলির নামগুলি প্যারেন্ট হাইড্রোকার্বনের নামের উপর ভিত্তি করে এবং অ্যামিনো গ্রুপের সাথে যুক্ত কার্বন পরমাণুর সংখ্যা নির্দেশ করে শেষ-অ্যামাইন যোগ করে।
শারীরিক বৈশিষ্ট্য. মেথাইলামাইন, ডাইমেথাইলামাইন এবং ট্রাইমেথাইলামাইন হল গ্যাস, অ্যালিফ্যাটিক সিরিজের মাঝামাঝি সদস্য তরল এবং উচ্চতর সদস্যগুলি কঠিন। তরল পর্যায়ে অ্যামাইন অণুর মধ্যে দুর্বল হাইড্রোজেন বন্ধন তৈরি হয়, যে কারণে অ্যামাইনগুলির স্ফুটনাঙ্ক সংশ্লিষ্ট হাইড্রোকার্বনের তুলনায় বেশি।
অ্যামাইনগুলি জলের সাথে দুর্বল হাইড্রোজেন বন্ধনও তৈরি করে, তাই কার্বন কঙ্কালের বৃদ্ধির সাথে সাথে জলে দ্রবণীয়তা হ্রাস পায়। নীচের অ্যামাইনগুলির একটি বৈশিষ্ট্যযুক্ত "মাছের" গন্ধ রয়েছে, যখন উচ্চতর অ্যামাইনগুলি গন্ধহীন।
রাসায়নিক বৈশিষ্ট্য.
1. প্রাপ্যতার কারণে ইলেকট্রন জোড়ানাইট্রোজেন পরমাণুতে, সমস্ত অ্যামিনের মৌলিক বৈশিষ্ট্য রয়েছে, অ্যালিফ্যাটিক অ্যামাইনগুলি অ্যামোনিয়ার চেয়ে শক্তিশালী ঘাঁটি।
অ্যামাইনগুলির জলীয় দ্রবণগুলির একটি ক্ষারীয় প্রতিক্রিয়া রয়েছে:
এমিনেস বিশুদ্ধ ফর্মঅথবা দ্রবণে তারা অ্যাসিডের সাথে মিথস্ক্রিয়া করে, লবণ তৈরি করে যা অ্যামোনিয়াম লবণের অ্যানালগ:
CH 3 NH 2 + H 2 SO 4 → HSO 4,
C 6 H 5 NH 2 + HCl → Cl.
অ্যামাইন লবণ হল কঠিন পদার্থ যা পানিতে অত্যন্ত দ্রবণীয় এবং অ-মেরু জৈব দ্রাবকগুলিতে খুব কম দ্রবণীয়। ক্ষারগুলি অ্যামাইন লবণকে মুক্ত অ্যামাইনগুলিতে রূপান্তরিত করে, ঠিক যেমন ক্ষারগুলি অ্যামোনিয়াম লবণ থেকে অ্যামোনিয়াকে স্থানচ্যুত করে।
Cl + NaOH → CH 3 NH 2 + NaCl + H 2 O।
2. অ্যামাইনগুলি অ্যামোনিয়ার জৈব অ্যানালগ, তাই তারা রূপান্তর ধাতুর সাথে জটিল যৌগ গঠন করতে পারে:
Cu 2+ + 4CH 3 NH 2 = 2+।
এই কমপ্লেক্সে অ্যামাইনের ইলেকট্রনের একক জোড়া কেন্দ্রীয় পরমাণুর বাইরের স্তরে একটি খালি অরবিটাল দখল করে, একটি দাতা-গ্রহণকারী বন্ধন তৈরি করে।
3. হাইড্রোক্লোরিক অ্যাসিড পাতলা করতে সোডিয়াম নাইট্রাইট যোগ করা হলে গঠিত নাইট্রাস অ্যাসিডের সাথে প্রাথমিক এবং মাধ্যমিক অ্যামাইনগুলি বিক্রিয়া করে:
NaNO 2 + HCl → HNO 2 + NaCl।
নাইট্রাস অ্যাসিডের ক্রিয়া দ্বারা প্রাথমিক অ্যামাইনগুলি অ্যালকোহলে রূপান্তরিত হয়:
RNH 2 + HNO 2 → ROH + N 2 + H 2 O.
এই বিক্রিয়ার মধ্যবর্তী হল অস্থির ডায়াজোনিয়াম + আয়ন।
নাইট্রাস অ্যাসিড সহ মাধ্যমিক অ্যামাইনগুলি এন-নাইট্রোসামাইন দেয় - একটি বৈশিষ্ট্যযুক্ত গন্ধযুক্ত তৈলাক্ত তরল:
R 2 NH + HO-N=O → R 2 N-N=O + H 2 O।
টারশিয়ারি অ্যালিফ্যাটিক অ্যামাইনগুলি নাইট্রাস অ্যাসিডের সাথে বিক্রিয়া করে না। সুতরাং, নাইট্রাস অ্যাসিড একটি বিকারক যা আপনাকে অ্যামাইনের ধরন নির্ধারণ করতে দেয়।
4. যখন অ্যামাইনগুলি জ্বলে, কার্বন ডাই অক্সাইড, নাইট্রোজেন এবং জল তৈরি হয়:
4C n H 2n+3 N + (6n+3)O 2 = 2N 2 + 4nCO 2 + (4n+6) H 2 O
প্রাপ্তি। 1. অ্যামাইন তৈরির প্রধান পদ্ধতি হ'ল অ্যামোনিয়ার অ্যালকাইলেশন, যা অ্যালকাইল হ্যালাইডগুলি চাপে অ্যামোনিয়া দিয়ে উত্তপ্ত হলে ঘটে:
CH 3 Cl + 2NH 3 → CH 3 NH 2 + NH 4 Cl.
যখন অ্যালকাইল হ্যালাইডের আধিক্য থাকে, ফলস্বরূপ প্রাথমিক অ্যামাইনটিও একটি অ্যালকাইলেশন প্রতিক্রিয়ার মধ্য দিয়ে যেতে পারে, একটি গৌণ বা তৃতীয় অ্যামাইন হয়ে উঠতে পারে, উদাহরণস্বরূপ:
CH 3 Cl + CH 3 NH 2 → (CH 3) 2 NH 2 + Cl - ,
2CH 3 Cl + CH 3 NH 2 → (CH 3) 3 NH+Cl - + HCl।
অনুশীলনে, এই ধরনের বিক্রিয়ায় প্রাথমিক, মাধ্যমিক এবং তৃতীয় অ্যামাইনগুলির লবণের মিশ্রণ পাওয়া যায়, যেখান থেকে অ্যামাইনগুলি ক্ষারের ক্রিয়ায় বিচ্ছিন্ন হয় এবং পাতন দ্বারা পৃথক করা হয়।
2. নিম্নলিখিত স্কিম অনুযায়ী নাইট্রো যৌগগুলি হ্রাস করে প্রাথমিক অ্যামাইনগুলিও পাওয়া যায়:
RNO 2 + 6[H] → RNH 2 + 2H 2 O
কমানোর জন্য, অ্যামোনিয়াম সালফাইড (জিনিন বিক্রিয়া), দস্তা বা লোহা ব্যবহার করা হয় অম্লীয় পরিবেশ, একটি ক্ষারীয় মাধ্যমে অ্যালুমিনিয়াম বা সরাসরি গ্যাস পর্যায়ে হাইড্রোজেন.
3. নাইট্রিল হ্রাস করে প্রাথমিক অ্যামাইনগুলি পাওয়া যেতে পারে:
R-C≡N + 4[H] → R-CH 2 -NH 2।
লিথিয়াম অ্যালুমিনিয়াম হাইড্রাইড LiAlH 4 একটি হ্রাসকারী এজেন্ট হিসাবে ব্যবহৃত হয়।
4. জৈবিক ব্যবস্থায়, অ্যামিনো অ্যাসিডের এনজাইমেটিক ডিকারবক্সিলেশন ঘটতে পারে:
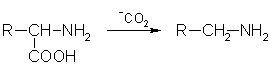
আবেদন।নিম্ন অ্যালিফ্যাটিক অ্যামাইনগুলি ওষুধ, কীটনাশক এবং প্লাস্টিকের সংশ্লেষণের জন্য ব্যবহৃত হয়।
বিষয়কে শক্তিশালী করার জন্য প্রশ্ন:
অ্যামাইনস কি?
অ্যামাইন কিভাবে শ্রেণীবদ্ধ করা হয়?
অ্যামাইনগুলির কী বৈশিষ্ট্য রয়েছে?
অ্যামাইন প্রাপ্তির কোন পদ্ধতি আপনি জানেন?
যা শারীরিক বৈশিষ্ট্যঅ্যামাইনের বৈশিষ্ট্য?
অ্যামাইন কোথায় ব্যবহার করা হয়?
স্যাচুরেটেড অ্যালিফ্যাটিক অ্যামাইনসের সাধারণ সূত্র কী?
লেকচার নং 30: অ্যামিনো অ্যাসিড। বৈশিষ্ট্য, উত্পাদন, আবেদন.
অ্যামিনো অ্যাসিড- এগুলি হল জৈব দ্বি-ফাংশনাল যৌগ, যার মধ্যে রয়েছে কার্বক্সিল গ্রুপ -COOH এবং অ্যামিনো গ্রুপ -NH 2। উভয় কার্যকরী গ্রুপের আপেক্ষিক অবস্থানের উপর নির্ভর করে, α-, β-, γ-অ্যামিনো অ্যাসিডগুলিকে আলাদা করা হয়:

α- aminopropionic β- aminopropionic
কার্বন পরমাণুর গ্রীক অক্ষর কার্বক্সিল গ্রুপ থেকে এর দূরত্ব নির্দেশ করে। এখানে শুধুমাত্র α-অ্যামিনো অ্যাসিড বিবেচনা করা হবে কারণ অন্য কোনো অ্যামিনো অ্যাসিড প্রাকৃতিকভাবে ঘটে না।
প্রোটিনে 19টি মৌলিক অ্যামিনো অ্যাসিড এবং একটি ইমিনো অ্যাসিড থাকে। সমস্ত প্রাকৃতিক অ্যামিনো অ্যাসিডের তুচ্ছ নাম রয়েছে।
আইসোমেরিজম।গ্লাইসিন ব্যতীত সমস্ত α-অ্যামিনো অ্যাসিডে, α-কার্বন পরমাণু চারটি ভিন্ন বিকল্পের সাথে আবদ্ধ থাকে, তাই এই সমস্ত অ্যামিনো অ্যাসিড দুটি আইসোমার (এন্যান্টিওমার) হিসাবে থাকতে পারে যা একে অপরের মিরর ইমেজ (অপটিক্যাল আইসোমেরিজম)। এর কনফিগারেশন ডি-গ্লিসারালডিহাইডের সাথে মিলে যায় কিনা তার উপর নির্ভর করে প্রতিটি আইসোমারকে ডি- বা এল-সিরিজ হিসাবে শ্রেণীবদ্ধ করা হয়:
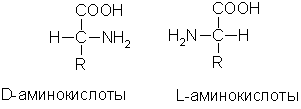
প্রাণীর প্রোটিনে শুধুমাত্র এল-অ্যামিনো অ্যাসিড থাকে।
শারীরিক বৈশিষ্ট্য. অ্যামিনো অ্যাসিড হল কঠিন স্ফটিক পদার্থ, জলে অত্যন্ত দ্রবণীয় এবং জৈব দ্রাবকগুলিতে সামান্য দ্রবণীয়। অনেক অ্যামিনো অ্যাসিড একটি মিষ্টি স্বাদ আছে।
রাসায়নিক বৈশিষ্ট্য. অ্যামিনো অ্যাসিড হল জৈব অ্যামফোটেরিক যৌগ। তারা অণুতে বিপরীত প্রকৃতির দুটি কার্যকরী গ্রুপ ধারণ করে: মৌলিক বৈশিষ্ট্য সহ একটি অ্যামিনো গ্রুপ এবং অ্যাসিডিক বৈশিষ্ট্যযুক্ত একটি কার্বক্সিল গ্রুপ। অ্যামিনো অ্যাসিড অ্যাসিড এবং ঘাঁটি উভয়ের সাথে প্রতিক্রিয়া করে:
H 2 N-CH 2 -COOH + HCl→ Cl[H 3 N-CH 2 -COOH],
H 2 N-CH 2 -COOH + NaOH → H 2 N-CH 2 -COONa + H 2 O.
যখন অ্যামিনো অ্যাসিডগুলি জলে দ্রবীভূত হয়, তখন কার্বক্সিল গ্রুপ একটি হাইড্রোজেন আয়ন সরিয়ে দেয়, যা অ্যামিনো গ্রুপের সাথে সংযুক্ত হতে পারে। এই ক্ষেত্রে, একটি অভ্যন্তরীণ লবণ গঠিত হয়, যার অণু একটি বাইপোলার আয়ন:
H 2 N-CH 2 -COOH → + H 3 N-CH 2 -COO - .
অ্যামিনো অ্যাসিডের সবচেয়ে গুরুত্বপূর্ণ বৈশিষ্ট্য হল পেপটাইড গঠনের জন্য তাদের ঘনীভূত করার ক্ষমতা।
গুণগত প্রতিক্রিয়া।
1) সমস্ত অ্যামিনো অ্যাসিড নিনহাইড্রিন দ্বারা অক্সিডাইজ করা হয় যাতে পণ্যগুলি রঙিন নীল-বেগুনি তৈরি করে। ইমিনো অ্যাসিড প্রোলিন নিনহাইড্রিন সহ একটি হলুদ রঙ দেয়। এই বিক্রিয়াটি স্পেকট্রোফটোমেট্রির মাধ্যমে অ্যামিনো অ্যাসিডের পরিমাণ নির্ধারণ করতে ব্যবহার করা যেতে পারে।
2) যখন সুগন্ধযুক্ত অ্যামিনো অ্যাসিড ঘনীভূত নাইট্রিক অ্যাসিড দিয়ে উত্তপ্ত করা হয়, তখন বেনজিন বলয়ের নাইট্রেশন ঘটে এবং যৌগগুলি রঙিন হয় হলুদ. এই প্রতিক্রিয়াকে বলা হয় জ্যান্থোপ্রোটিন (গ্রীক জ্যান্থোস থেকে - হলুদ)।
প্রাপ্তি. অ্যামিনো অ্যাসিড পাওয়ার প্রধান উপায় হল হ্যালোজেন অ্যাসিডের অ্যামিনো গ্রুপের সাথে হ্যালোজেন পরমাণু প্রতিস্থাপন করা। এই পদ্ধতিটি অ্যালকাইল হ্যালাইড এবং অ্যামোনিয়া থেকে অ্যামাইন তৈরির অনুরূপ। প্রতিস্থাপনের সময় মুক্তি পাওয়া হাইড্রোজেন হ্যালাইড অতিরিক্ত অ্যামোনিয়া দিয়ে আবদ্ধ থাকে:
Cl-CH(R)-COOH + 2NH 3 → H 2 N-CH(R)-COOH + NH 4 Cl.
কোন পদার্থকে অ্যামিনো অ্যাসিড বলা হয়?
কিভাবে অ্যামিনো অ্যাসিড শ্রেণীবদ্ধ করা হয়?
অ্যামিনো অ্যাসিডের বৈশিষ্ট্য কী কী শারীরিক বৈশিষ্ট্য?
অ্যামিনো অ্যাসিডের বৈশিষ্ট্য কোন গুণগত বিক্রিয়া?
অ্যামিনো অ্যাসিডের বৈশিষ্ট্য কী ধরনের আইসোমেরিজম?
অ্যামিনো অ্যাসিড কোথায় ব্যবহৃত হয়?
অ্যামিনো অ্যাসিডের পলিকনডেনসেশন বিক্রিয়ার ফলে কী তৈরি হয়?
অ্যামিনো অ্যাসিড পাওয়ার কোন পদ্ধতি আপনি জানেন?
বাইপোলার আয়ন কি?
লেকচার নং 31: হেটেরোসাইক্লিক যৌগের ধারণা।
হেটেরোসাইক্লিক যৌগ- জৈব যৌগগুলি তাদের অণুতে চক্র ধারণ করে, যার গঠনে অ-কার্বন পরমাণু (হেটারোআটম) অংশ নেয়। হেটেরোসাইক্লিক যৌগগুলি রিংয়ের পরমাণুর সংখ্যা এবং হেটেরোটমের প্রকার অনুসারে শ্রেণিবদ্ধ করা হয়।
ছয় সদস্য বিশিষ্ট হেটারোসাইকেল
পাইরিডিন সি 5 এইচ 5 এন হল একটি নাইট্রোজেন পরমাণু সহ সবচেয়ে সহজ ছয় সদস্য বিশিষ্ট সুগন্ধি হেটেরোসাইকেল। এটি বেনজিনের একটি অ্যানালগ হিসাবে বিবেচনা করা যেতে পারে, যেখানে একটি CH গ্রুপ একটি নাইট্রোজেন পরমাণু দ্বারা প্রতিস্থাপিত হয়:

গঠন।পাইরিডিনের ইলেকট্রনিক গঠন বেনজিনের মতো। সমস্ত কার্বন পরমাণু এবং নাইট্রোজেন পরমাণু sp 2 হাইব্রিডাইজেশন অবস্থায় রয়েছে। নন-হাইব্রিড অরবিটালে অবস্থিত ছয়টি ইলেকট্রন (প্রতিটি পরমাণু থেকে একটি) একটি পি-ইলেক্ট্রন অ্যারোমেটিক সিস্টেম তৈরি করে। নাইট্রোজেন পরমাণুর তিনটি হাইব্রিড অরবিটালের মধ্যে দুটি σ গঠনে প্রবেশ করে -C-N বন্ড, এবং তৃতীয়টিতে একজোড়া ইলেকট্রন রয়েছে।
শারীরিক বৈশিষ্ট্য. পাইরিডিন একটি বর্ণহীন তরল, জলের চেয়ে সামান্য হালকা, একটি চরিত্রগত অপ্রীতিকর গন্ধ সহ; যে কোন অনুপাতে পানির সাথে মিশে যায়।
রাসায়নিক বৈশিষ্ট্যপাইরিডিন একটি সুগন্ধি সিস্টেম এবং একটি একা ইলেক্ট্রন জোড়া সহ একটি নাইট্রোজেন পরমাণুর উপস্থিতি দ্বারা নির্ধারিত হয়।
1. মৌলিক বৈশিষ্ট্য। পাইরিডিন হল অ্যালিফ্যাটিক অ্যামাইনের চেয়ে দুর্বল বেস (Kb = 1.7.10 -9)। তার জল সমাধানলিটমাস নীল হয়ে যায়:

যখন pyridine সাথে যোগাযোগ করে শক্তিশালী অ্যাসিডপাইরিডিনিয়াম লবণ গঠিত হয়:
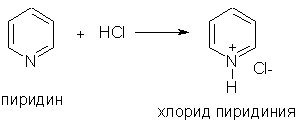
2. সুগন্ধি বৈশিষ্ট্য. বেনজিনের মতো, পাইরিডিন ইলেক্ট্রোফিলিক প্রতিস্থাপন প্রতিক্রিয়ার মধ্য দিয়ে যায়, কিন্তু নাইট্রোজেন পরমাণুর উচ্চ বৈদ্যুতিক ঋণাত্মকতার কারণে এই বিক্রিয়ায় এর কার্যকলাপ বেনজিনের চেয়ে কম। পাইরিডিন কম ফলন সহ 300 ডিগ্রি সেলসিয়াসে নাইট্রেট করা হয়:

ইলেক্ট্রোফিলিক প্রতিস্থাপন বিক্রিয়ায় নাইট্রোজেন পরমাণুটি ২য় ধরণের প্রতিস্থাপন হিসাবে আচরণ করে, তাই মেটা অবস্থানে ইলেক্ট্রোফিলিক প্রতিস্থাপন ঘটে।
বেনজিনের বিপরীতে, পাইরিডিন নিউক্লিওফিলিক প্রতিস্থাপন প্রতিক্রিয়ার মধ্য দিয়ে যেতে সক্ষম, যেহেতু নাইট্রোজেন পরমাণু সুগন্ধি সিস্টেম থেকে ইলেক্ট্রন ঘনত্ব টেনে নেয় এবং নাইট্রোজেন পরমাণুর সাথে সম্পর্কিত অর্থো-প্যারা অবস্থানগুলি ইলেক্ট্রন-ক্ষয়প্রাপ্ত হয়। এইভাবে, পাইরিডিন সোডিয়াম অ্যামাইডের সাথে বিক্রিয়া করতে পারে, যা অর্থো- এবং প্যারা-অ্যামিনোপাইরিডাইনস (চিচিবাবিন প্রতিক্রিয়া) এর মিশ্রণ তৈরি করে:
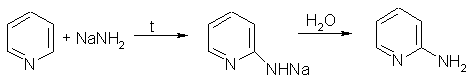
3. পাইরিডিনের হাইড্রোজেনেশন পাইপিরিডিন তৈরি করে, যা একটি চক্রীয় সেকেন্ডারি অ্যামাইন এবং পাইরিডিনের চেয়ে অনেক শক্তিশালী ভিত্তি:

4. পাইরিডিন হোমোলগগুলি বেনজিন হোমোলগগুলির বৈশিষ্ট্যে অনুরূপ। এইভাবে, যখন পার্শ্ব চেইনগুলি অক্সিডাইজ করা হয়, তখন সংশ্লিষ্ট কার্বক্সিলিক অ্যাসিডগুলি গঠিত হয়:

নিকোটিনিক অ্যাসিড এবং এর অ্যামাইড গুরুত্বপূর্ণ ওষুধ
Pyrimidine C 4 H 4 N 2 হল দুটি নাইট্রোজেন পরমাণু সহ একটি ছয় সদস্য বিশিষ্ট হেটেরোসাইকেল। এটি বেনজিনের একটি অ্যানালগ হিসাবে বিবেচনা করা যেতে পারে, যেখানে দুটি সিএইচ গ্রুপ নাইট্রোজেন পরমাণু দ্বারা প্রতিস্থাপিত হয়:

রিংটিতে দুটি ইলেক্ট্রোনেগেটিভ নাইট্রোজেন পরমাণুর উপস্থিতির কারণে, পাইরিমিডিন পাইরিডিনের তুলনায় ইলেক্ট্রোফিলিক প্রতিস্থাপন বিক্রিয়ায় এমনকি কম সক্রিয়। এর মৌলিক বৈশিষ্ট্যগুলিও পাইরিডিনের তুলনায় কম উচ্চারিত।
পাইরিমিডিনের প্রধান তাৎপর্য হল এটি পাইরিমিডিন বেস শ্রেণীর পূর্বপুরুষ।
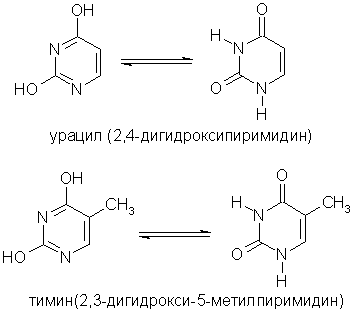
পাইরিমিডিন বেসগুলি পাইরিমিডিন ডেরিভেটিভস, যার অবশিষ্টাংশগুলি নিউক্লিক অ্যাসিডের অংশ: ইউরাসিল, থাইমিন, সাইটোসিন।
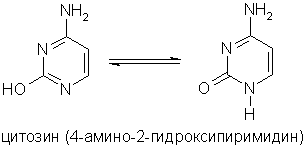
প্রাপ্তি. পাইরিডিন কয়লা আলকাতরা থেকে বিচ্ছিন্ন, যেখানে এর উপাদান 0.08%। পরীক্ষাগার অবস্থায়, পাইরিডিন হাইড্রোসায়ানিক অ্যাসিড এবং অ্যাসিটিলিন থেকে সংশ্লেষিত হতে পারে:
2HC≡CH + HC≡N→ গ 5 এইচ 5 এন.
বিষয়কে শক্তিশালী করার জন্য প্রশ্ন:
ব্যাখ্যামূলক নোট (6)
ব্যাখ্যামূলক টীকাব্যাখ্যামূলক একটি নোটএই প্রোগ্রামটি শেখানোর জন্য ডিজাইন করা হয়েছে...
ব্যাখ্যামূলক নোট (7)
ব্যাখ্যামূলক টীকাব্যাখ্যামূলক একটি নোট পরীক্ষাগারের কাজব্যাপারটা হলো...
হেটেরোসাইক্লিক যৌগ কোন পদার্থ?
কিভাবে heterocyclic যৌগ শ্রেণীবদ্ধ করা হয়?
কি রাসায়নিক বৈশিষ্ট্য তাদের বৈশিষ্ট্য?
হেটেরোসাইক্লিক যৌগ কোথায় পাওয়া যায়?
ব্যাখ্যামূলক একটি নোটএই প্রোগ্রামটি শেখানোর জন্য ব্যবহৃত হয়...
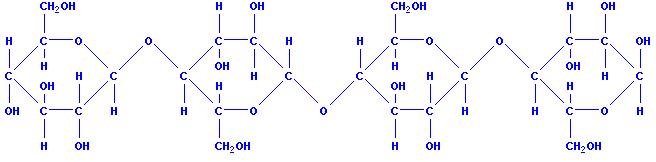
নিজস্ব উপায়ে রাসায়নিক প্রকৃতিমাড়, যেমন সমস্ত শর্করা (গ্লুকোজ, সুক্রোজ এবং অন্যান্য), সেইসাথে ফাইবার (সেলুলোজ) শ্রেণীর অন্তর্গত কার্বোহাইড্রেট. তা নির্ধারণ করেছেন স্টার্চ অণুদুটি নিয়ে গঠিত উপাদান- অ্যামাইলোজ এবং অ্যামাইলোপেক্টিন। কর্ন স্টার্চে, অ্যামাইলোজ পদার্থের মোট ভরের এক চতুর্থাংশ এবং অ্যামাইলোপেকটিন তিন চতুর্থাংশ তৈরি করে। অন্যান্য স্টার্চে এই দুটি অংশের অনুপাত কিছুটা আলাদা; উদাহরণস্বরূপ, মধ্যে আলু মাড়অ্যামাইলোজ প্রায় 20% এবং অ্যামাইলোপেক্টিন 80% তৈরি করে। অ্যামাইলোজ এবং অ্যামাইলোপেক্টিন একে অপরের থেকে আলাদা রাসায়নিক গঠন, কিন্তু এই উভয় অংশই গ্লুকোজ অণুর অবশিষ্টাংশ নিয়ে গঠিত। আসুন স্টার্চের বৈশিষ্ট্যগুলি ঘনিষ্ঠভাবে দেখে নেওয়া যাক।
স্টার্চ সূত্র
স্টার্চ অণু বিভিন্ন আকার আছে এবং ঠান্ডা জল অদ্রবণীয় হয়. নিম্নলিখিত সূত্র আছে: (C 6 H 10 O 5)n.
স্টার্চ অণু
সাধারনত স্টার্চ অণুএকে অপরের সাথে সংযুক্ত প্রায় সাড়ে ছয় হাজার গ্লুকোজ অবশিষ্টাংশ নিয়ে গঠিত। এই অবশেষ যেমন ছিল, শাখাযুক্ত শিকল। সুতরাং, স্টার্চ একটি প্রাকৃতিক পলিমার। সর্বোপরি, এখন পরিচিত শব্দ "পলিমার" এর অর্থ অনেকগুলি অভিন্ন, তুলনামূলকভাবে সহজ কণার সমন্বয়ে গঠিত একটি পদার্থ। স্টার্চের উৎপত্তি নির্বিশেষে, এটি ভুট্টা বা আলু, চাল বা গম যাই হোক না কেন, এটি অবিকল পদার্থ। স্টার্চ শস্য একে অপরের থেকে শুধুমাত্র আকার এবং আকারে পৃথক।
ভুট্টার স্টার্চের দানা গোলাকার বা কম সাধারণভাবে বহুভুজ আকৃতির হয়। তাদের আকার 2 থেকে 30 মাইক্রন পর্যন্ত; প্রায়শই আপনাকে 20-25 মাইক্রন আকারের শস্যের সাথে মোকাবিলা করতে হবে।
স্টার্চের শারীরিক বৈশিষ্ট্য
খুব কৌতূহলী শারীরিক স্টার্চ বৈশিষ্ট্য. ঠান্ডা জলে এটি খুব কম জল (25-30%) শোষণ করে এবং লক্ষণীয়ভাবে ফুলে যায় না। কিন্তু ইতিমধ্যে 60 ডিগ্রি সেলসিয়াসের উপরে তাপমাত্রায়, কর্ন স্টার্চ তার নিজের ওজনের 3 গুণ জল শোষণ করে। এই ক্ষেত্রে, স্টার্চের জেলটিনাইজেশন ঘটে। যদি তাপমাত্রা 70 ডিগ্রি সেলসিয়াসে বাড়ানো হয়, তাহলে স্টার্চ প্রায় 100% জল শোষণ করে। সর্বাধিক স্টার্চ 2500% পর্যন্ত জল শোষণ এবং ধরে রাখতে পারে, অর্থাৎ তার নিজের ওজনের 25 গুণ। স্টার্চের আশ্চর্যজনক "শক্তি"!
বিপ্লবের আগে, আমাদের দেশে স্টার্চ প্রায় একচেটিয়াভাবে আলু থেকে পাওয়া যেত। কর্ন স্টার্চ উৎপাদন ছিল মাত্র এক শতাংশ মোট উৎপাদনমাড়.
প্রকৃতিতে শারীরিক বৈশিষ্ট্য এবং ঘটনা।
1. স্টার্চ হল একটি সাদা পাউডার যা পানিতে অদ্রবণীয়।
2. গরম জলে এটি ফুলে যায় এবং একটি কলয়েডাল দ্রবণ তৈরি করে - একটি পেস্ট।
3. সবুজ (ক্লোরোফিল-যুক্ত) উদ্ভিদ কোষ দ্বারা কার্বন মনোক্সাইড (IV) শোষণের একটি পণ্য হওয়ায়, স্টার্চ উদ্ভিদ জগতে ব্যাপক।
4. আলুর কন্দে প্রায় 20% স্টার্চ, গম এবং ভুট্টার দানা থাকে - প্রায় 70%, চাল - প্রায় 80%।
5. স্টার্চ সবচেয়ে গুরুত্বপূর্ণ এক পরিপোষক পদার্থএকজন ব্যক্তির জন্য
স্টার্চের গঠন।
1. স্টার্চ (C 6 H 10 O 5) n একটি প্রাকৃতিক পলিমার।
2. এটি সৌর বিকিরণের শক্তি শোষণ করার সময় উদ্ভিদের সালোকসংশ্লেষী কার্যকলাপের ফলে গঠিত হয়।
3. প্রথমত, বিভিন্ন প্রক্রিয়ার ফলে কার্বন ডাই অক্সাইড এবং জল থেকে গ্লুকোজ সংশ্লেষিত হয়, যা সাধারণ দৃষ্টিকোণসমীকরণ দ্বারা প্রকাশ করা যেতে পারে: 6CO 2 + 6H 2 O = C 6 H 12 O 6 + 6O 2।
5. স্টার্চের ম্যাক্রোমোলিকিউলস আকারে একই নয়: ক) তারা ধারণ করে ভিন্ন সংখ্যা C 6 H 10 O 5 ইউনিট - কয়েকশ থেকে কয়েক হাজার পর্যন্ত, যখন তাদের আণবিক ওজনও আলাদা; খ) তারা গঠনে ভিন্ন: রৈখিক অণুর সাথে আণবিক ভরকয়েক লক্ষের মধ্যে একটি শাখাযুক্ত কাঠামোর অণু রয়েছে, যার আণবিক ওজন কয়েক মিলিয়নে পৌঁছেছে।
স্টার্চের রাসায়নিক বৈশিষ্ট্য।
1. স্টার্চের বৈশিষ্ট্যগুলির মধ্যে একটি হল আয়োডিনের সাথে মিথস্ক্রিয়া করার সময় একটি নীল রঙ দেওয়ার ক্ষমতা। আপনি যদি আলু কাটা বা স্লাইসে এক ফোঁটা আয়োডিন দ্রবণ রাখেন তবে এই রঙটি পর্যবেক্ষণ করা সহজ। সাদা রুটিএবং কপার (II) হাইড্রোক্সাইড দিয়ে স্টার্চ পেস্ট গরম করুন, তামা (I) অক্সাইডের গঠন দৃশ্যমান হবে।
2. আপনি যদি অল্প পরিমাণে সালফিউরিক অ্যাসিড দিয়ে একটি স্টার্চ পেস্ট সিদ্ধ করেন, দ্রবণটিকে নিরপেক্ষ করে এবং তামা (II) হাইড্রক্সাইডের সাথে বিক্রিয়া করেন, তামা (I) অক্সাইডের একটি বৈশিষ্ট্যযুক্ত অবক্ষেপ তৈরি হয়। অর্থাৎ, যখন অ্যাসিডের উপস্থিতিতে জল দিয়ে উত্তপ্ত করা হয়, তখন স্টার্চ হাইড্রোলাইসিসের মধ্য দিয়ে যায়, ফলে একটি পদার্থ যা তামা (II) হাইড্রোক্সাইডকে কপার (I) অক্সাইডে পরিণত করে।
3. জলের সাথে স্টার্চ ম্যাক্রোমোলিকিউলগুলিকে বিভক্ত করার প্রক্রিয়া ধীরে ধীরে ঘটে। প্রথমত, স্টার্চের তুলনায় কম আণবিক ওজন সহ মধ্যবর্তী পণ্যগুলি গঠিত হয় - ডেক্সট্রিনস, তারপর সুক্রোজের একটি আইসোমার - মাল্টোজ, হাইড্রোলাইসিসের চূড়ান্ত পণ্য হল গ্লুকোজ।
4. সালফিউরিক অ্যাসিডের অনুঘটক ক্রিয়ায় স্টার্চকে গ্লুকোজে রূপান্তরিত করার প্রতিক্রিয়া 1811 সালে একজন রাশিয়ান বিজ্ঞানী আবিষ্কার করেছিলেন K. Kirchhoff.গ্লুকোজ উৎপাদনের জন্য তিনি যে পদ্ধতি তৈরি করেছিলেন তা আজও ব্যবহৃত হয়।
5. স্টার্চ ম্যাক্রোমোলিকিউলস চক্রীয় এল-গ্লুকোজ অণুর অবশিষ্টাংশ নিয়ে গঠিত।
- < Назад
- ফরোয়ার্ড >