Крахмал физические свойства. Крахмал
Химия - уникальнейшая и интересная наука, при помощи которой можно объяснить многие процессы, происходящие вокруг нас в жизни. Например, почему железо постепенно ржавеет, а также, почему алюминиевая ложка так быстро нагревается, если ее опустить в горячий чай. Химия окружает нас абсолютно везде: уксусная кислота или уксус, или всем известная поваренная соль, а также такие вещества как йод, хлорка, спирт и многие другие. Но есть в химии такое вещество, которое известно каждому, и называется оно можно получить и методом химическим, но чаще всего его добывают из картофеля. Давайте более подробно рассмотрим, все, что с ним связано, начиная химической формулой и заканчивая его свойствами и тем, как крахмал можно распознать.
Крахмал, формула котрого выглядит следующим образом: С6Н10О5, имеет ряд интересных свойств. Например, всеми любимый кисель застывает только по той причине, что в нем содержится достаточно большое количество крахмала. Выглядит крахмал как обычный порошок, не имеет запаха, практически лишен вкуса, а самое интересное заключается в том, что он скрипит, если его немного потереть. Это крахмала обусловлено тем, что молекулы крахмала достаточно большие.
Вообще крахмал, формула его и некоторые свойства были открыты относительно недавно. Вырабатывается крахмал растениями, причем, не только картофелем, но и другими, такими как, например, кукуруза и пшеница. В картофеле крахмала содержится всего двадцать процентов, а в пшеничных и кукурузных зернах его количество превышает отметку в семьдесят процентов. Образуется крахмал тогда, когда при фотосинтезе идет соединение шести молекул углекислого газа и пяти молекул воды, после чего образуется одна молекула крахмала и шесть молекул кислорода.
Как было указано выше, химическая формула крахмала содержит шесть атомов углерода, десять атомов водорода и пять кислородных атомов. Это говорит не только о том, что молекула крахмала очень большая, но и о том, что она имеет абсолютно органическое происхождение, то есть, является принадлежной к разделу химии, именуемой органикой. Это вещество считается сложным, относится к разделу полисахаридов, хотя сахаром или подобным ему веществом он не является. Также крахмал относят к органическим веществам, содержащим кислород, или иначе - кислородсодержащим органическим веществам.
Крахмала также считается сложной, ее строение можно посмотреть в интернете, так как передать на письме ее просто невозможно. Можно лишь сказать, что крахмал, формула его точнее, содержит несколько ОН-групп, каждая из которых соединена с атомом углерода. Многие путают эту молекулу с молекулой какого-либо спирта, когда слышат про ОН-группу, но на самом деле в молекуле С6Н10О5 кроется крахмал.
Если Вы хотите распознать крахмал, то Вам не нужно много и долго над этим думать. Качественная реакция на наличие крахмала в веществе заключается в следующем: в пробирку просто капают несколько капель раствора йода. Если раствор сразу становится сним, то Вы без сомнения можете подписать пробирку и быть уверенным, что в ней крахмал. Если хотите проверить данную реакцию в ломашних условиях, то возьмите небольшую картофелину, разрежьте ее, после чего аккуратно пипеткой капните несколько капель йода (того, что продается в аптеках для прижигания ранок). Через какое-то время Вы увидите очевидный эффект качественной реакции на крахмал: картофелина в месте, куда попал йод, постепенно начнет синеть.
Итак, теперь Вы знаете о крахмале достаточно много (что такое крахмал, формула, свойства и качественную реакцию). Конечно, вся вышеуказанная информация не является полной, но, если Вы готовитесь к зачету по органической химии, она Вам непременно поможет.
Строение крахмала.
Крахмал состоит из 2 полисахаридов - амилозы и амилопектина, образованных остатками глюкозы. Экспериментально доказано, что химическая формула крахмала[С 6 (Н 2 О) 5 ]n.
Установлено, что крахмал состоит не только из линейных молекул, но и из молекул разветвленной структуры. Этим объясняется зернистое строение крахмала.
Нахождение в природе. Получение крахмала.
Накапливается в виде зерен, главным образом в клетках семян, луковиц, клубней, а также в листьях и стеблях. Крахмал - белый порошок, нерастворимый в холодной воде. В горячей воде он набухает и образует клейстер.Крахмал чаще всего получают из картофеля. Для этого картофель измельчают, промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Полученный крахмал еще раз промывают водой, отстаивают и сушат в струе теплого воздуха.
Применение крахмала.
Крахмал - основная часть важнейших продуктов питания: муки (75 - 80%), картофеля (25%), саго и др. Энергетическая ценность около 16,8 кДж/г.
Он является ценным питательным продуктом. Чтобы облегчить его усвоение, содержащие крахмал продукты подвергают действию высокой температуры, то есть картофель варят, хлеб пекут. В этих условиях происходит частичный гидролиз крахмала и образуются декстрины, растворимые в воде. Декстрины в пищеварительном тракте подвергаются дальнейшему гидролизу до глюкозы, которая усваивается организмом. Избыток глюкозы превращается в гликоген (животный крахмал). Состав гликогена такой же, как у крахмала, [С 6 (Н 2 О) 5 ]n., но его молекулы более разветвленные. Особенно много гликогена содержится в печени (до 10%). В организме гликоген является резервным веществом, которое превращается в глюкозу по мере ее расходования в клетках.
В промышленности крахмал путем гидролиза превращают в патоку и глюкозу. Для этого его нагревают с разбавленной серной кислотой, избыток которой затем нейтрализуют мелом.
Образовавшийся осадок сульфата кальция отфильтровывают, раствор упаривают и выделяют глюкозу. Если гидролиз крахмала не доводить до конца, то образуется смесь декстринов с глюкозой - патока, которую применяют в кондитерской промышленности. Получаемые с помощью крахмала декстрины используются в качестве клея, для загустения красок при нанесении рисунков на ткань.
Крахмал применяют для накрахмаливания белья. Под горячим утюгом происходит частичный гидролиз крахмала и превращение его в декстрины. Последние образуют на ткани плотную пленку, которая придает блеск ткани и предохраняет ее от загрянения. Крахмал и его производные также применяются при производстве бумаги, текстильных изделий, в литейном и других производствах, а также в фармацевтической промышленности.
Молекулярная формула целлюлозы, [С 6 (Н 2 О) 5 ]n как и у крахмала.
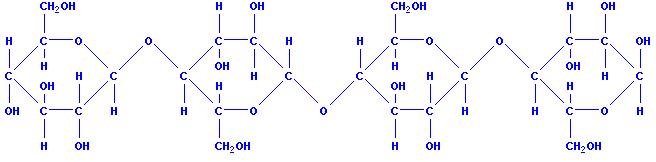
Целлюлоза тоже является природным полимером. Ее макромалекула состоит из многих остатков молекул глюкозы. Может воэникнуть вопрос: почему крахмал и целлюлоза – вещества с одинаковой молекулярной формулой – обладают различными свойствами?
При рассмотрении синтетических полимеров мы уже выяснили, что их свойства зависят от числа элементарных звеньев и их структуры. Это же положение относится и к природным полимерам. Оказывается, степень полимеризации у целлюлозы намного больше, чем у крахмала. Кроме того, сравнивая структуры этих природных полимеров, установили, что макромолекулы целлюлозы, в отличие от крахмала, состоят из остатков молекулы (-глюкозы и имеют только линейное строение. Макромолекулы целлюлозы располагаются в одном направлении и образуют волокна (лен, хлопок, конопля).
В каждом остатке молекулы глюкозы содержатся три гидроксильные группы. Целлюлоза – волокнистое вещество. Она не плавится и не переходит в парообразное состояние: при нагревании примерно до 350оС целлюлоза разлагается – обугливается. Целлюлоза нерастворима ни в воде, ни в большинстве других неорганических и органических растворителях.
Растворителем целлюлозы является реактив Швейцера – раствор гидроксида меди (II) с аммиаком, с которым она одновременно и взаимодействует. Концентрированные кислоты (серная, фосфорная) и концентрированный раствор хлорида цинка также растворяют целлюлозу, но при этом происходит ее частичный распад (гидролиз), сопровождающийся уменьшением молекулярной массы.
Применение целлюлозы .
Целлюлоза используется человеком с очень древних времен. Сначала применяли древесину как горючий и строительный материал; затем хлопковые, льняные и другие волокна стали использовать как текстильное сырье. Первые промышленные способы химической переработки древесины возникли в связи с развитием бумажной промышленности. Бумага – это тонкий слой волокон клетчатки, спрессованных и проклеенных для создания механической прочности, гладкой поверхности, для предотвращения растекания чернил. Первоначально для изготовления бумаги употребляли растительное сырье, из которого чисто механически можно было получить необходимые волокна, стебли риса (так называемая рисовая бумага), хлопка, использовали также изношенные ткани. Однако по мере развития книгопечатания перечисленных источников сырья стало не хватать для удовлетворения растущей потребности бумаги. Особенно много бумаги расходуется для печатания газет, причем вопрос о качестве (белизне, прочности, долговечности) для газетной бумаги значения не имеет. Зная, что древесина примерно на 50% состоит из клетчатки, к бумажной массе стали добавлять размолотую древесину. Такая бумага непрочна и быстро желтеет (особенно на свету). Для улучшения качества древесных добавок к бумажной массе были предложены различные способы химической обработки древесины, позволяющие получить из нее более или менее чистую целлюлозу, освобожденную от сопутствующих веществ – лигнина, смол и других. Для выделения целлюлозы было предложено несколько способов.По сульфитному способу измельченную древесину ”варят “ под давлением с гидросульфитом кальция. При этом сопутствующие вещества растворяются, и освобожденную от примесей целлюлозу отделяют фильтрованием. Образующиеся сульфитные щелока являются в бумажном производстве отходами. Однако вследствие того, что они содержат наряду с другими веществами способные к брожению моносахариды, их используют как сырье для получения этилового спирта (так называемый гидролизный спирт). Целлюлоза используется для получения вискозного, ацетатного, медно-аммиачного волокон.
Какие вещества относятся к углеводам?
Как можно классифицировать углеводы?
Где встречаются углеводы?
Какова биологическая роль углеводов?
Какие химические свойства характерны для глюкозы?
Сопоставьте свойства крахмала и целлюлозы.
Где применяется крахмал?
Где применяются реакции брожения глюкозы?
Лекция № 29: Амины. Состав. Строение. Свойства.
Амины - органические соединения, которые рассматривают как производные аммиака, в котором атомы водорода (один, два или три) замешены на углеводородные радикалы. Амины делятся на первичные, вторичные, третичные в зависимости от того, сколько атомов водорода замещено на радикал:
первичные вторичные третичные
амины амины амины
В зависимости от природы радикалов, амины могут быть алифатическими (предельными и непредельными), алициклическими, ароматическими или смешанными.
Общая формула предельных алифатических аминов С n Н 2n+3 N.
Строение. Атом азота в молекулах аминов находится в состоянии sp 3 -гибридизации. Три из четырех гибридных орбиталей участвуют в образовании σ-связей N-C и N-H, на четвертой орбитали находится неподеленная электронная пара, которая обусловливает основные свойства аминов. Названия аминов обычно производят, перечисляя углеводородные радикалы (в алфавитном порядке) и добавляя окончание –амин.
Электронодонорные заместители (предельные углеводородные радикалы) увеличивают электронную плотность на атоме азота и усиливают основные свойства аминов, поэтому вторичные амины - более сильные основания, чем первичные, поскольку два радикала создают на атоме азота большую электронную плотность, чем один. В третичных аминах важную роль играет пространственный фактор: три радикала загораживают электронную пару атома азота и затрудняют ее взаимодействие с другими молекулами, поэтому основность третичных аминов меньше, чем первичных или вторичных.
Изомерия аминов связана со строением углеродного скелета и положением аминогруппы:
бутиламин втор-бутиламин изобутиламин
(бутанамин-1) (бутанамин-2) (2-метилпропанамин-1)
Кроме того, первичные, вторичные и третичные амины, содержащие одинаковое число атомов углерода, изомерны между собой, например:
CH 3 -CH 2 -NH 2 CH 3 -NH-CH 3
этиламин диметиламин
Номенклатура.
C 2 H 5 -NH 2 CH 3 -NH-C 2 H 5 (CH 3) 3 N
этиламин метилэтиламин триметиламин
По другой системе названия первичных аминов строят, исходя из названия родоначального углеводорода и добавляя окончание -амин с указанием номера атома углерода, связанного с аминогруппой.
Физические свойства . Метиламин, диметиламин и триметиламин - газы, средние члены алифатического ряда - жидкости, высшие - твердые вещества. Между молекулами аминов в жидкой фазе образуются слабые водородные связи, поэтому температуры кипения аминов выше, чем у соответствующих углеводородов.
Амины также образуют слабые водородные связи с водой, поэтому низшие амины хорошо растворимы в воде, по мере роста углеродного скелета растворимость в воде уменьшается. Низшие амины имеют характерный «рыбный» запах, высшие не имеют запаха.
Химические свойства .
1. Благодаря наличию электронной пары на атоме азота, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями, чем аммиак.
Водные растворы аминов имеют щелочную реакцию:
Амины в чистом виде или в растворах взаимодействуют с кислотами, образуя соли, которые являются аналогами солей аммония:
CH 3 NH 2 + H 2 SO 4 → HSO 4 ,
C 6 H 5 NH 2 + HCl → Cl.
Соли аминов - твердые вещества, хорошо растворимые в воде и плохо растворимые в неполярных органических растворителях. Щелочи превращают соли аминов в свободные амины подобно тому, как из солей аммония щелочи вытесняют аммиак.
Cl + NaOH→ CH 3 NH 2 + NaCl + Н 2 О.
2. Амины - органические аналоги аммиака, поэтому они могут образовывать комплексные соединения с переходными металлами:
Сu 2+ + 4CH 3 NH 2 = 2+ .
Неподеленная пара электронов амина в этих комплексах занимает свободную орбиталь во внешнем слое центрального атома, образуя донорно-акцепторную связь.
3. Первичные и вторичные амины реагируют с азотистой кислотой, образующейся при добавлении нитрита натрия к разбавленной соляной кислоте:
NaNO 2 + HCl → HNO 2 + NaCl.
Первичные амины под действием азотистой кислоты превращаются в спирты:
RNH 2 + HNO 2 → ROH + N 2 + H 2 O.
Промежуточным соединением в этой реакции является неустойчивый ион диазония + .
Вторичные амины с азотистой кислотой дают N-нитрозамины - маслянистые жидкости с характерным запахом:
R 2 NH + HO-N=O → R 2 N-N=O + Н 2 О.
Третичные алифатические амины с азотистой кислотой не реагируют. Таким образом, азотистая кислота - реагент, позволяющий определять тип амина.
4. При сгорании аминов образуются углекислый газ, азот и вода:
4C n H 2n+3 N + (6n+3)O 2 = 2N 2 + 4nCO 2 + (4n+6)Н 2 О
Получение. 1. Основной способ получения аминов - алкилирование аммиака, которое происходит при нагревании алкилгалогенидов с аммиаком под давлением:
СН 3 Сl + 2NН 3 → CH 3 NH 2 + NH 4 Cl.
При избытке алкилгалогенида полученный первичный амин также может вступать в реакцию алкилирования, превращаясь во вторичный или третичный амин, например:
СН 3 Сl + CH 3 NH 2 → (СН 3) 2 NН 2 +Сl - ,
2CH 3 Cl + CH 3 NH 2 → (CH 3) 3 NH+Cl - + HCl.
Практически в таких реакциях получается смесь солей первичного, вторичного и третичного аминов, из которой амины выделяют под действием щелочи и разделяют путем перегонки.
2. Первичные амины также получают восстановлением нитросоединений по схеме:
RNO 2 + 6[Н] → RNH 2 + 2Н 2 О.
Для восстановления используют сульфид аммония (реакция Зинина), цинк или железо в кислой среде, алюминий в щелочной среде или непосредственно водород в газовой фазе.
3. Первичные амины можно получать восстановлением нитрилов:
R-C≡N + 4[Н] → R-CH 2 -NH 2 .
В качестве восстановителя используют алюмогидрид лития LiAlH 4 .
4. В биологических системах может происходить ферментативное декарбоксилирование аминокислот:
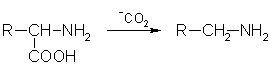
Применение. Низшие алифатические амины используются для синтеза лекарственных средств, пестицидов и пластмасс.
Вопросы для закрепления темы:
Что собой представляют амины?
Как классифицируются амины?
Какими свойствами обладают амины?
Какие способы получения аминов вы знаете?
Какие физические свойства характерны для аминов?
Где применяются амины?
Какова общая формула предельных алифатических аминов?
Лекция № 30: Аминокислоты. Свойства, получение, применение.
Аминокислоты - это органические бифункциональные соединения, в состав которых входят карбоксильная группа -СООН и аминогруппа -NН 2 . В зависимости от взаимного расположения обеих функциональных групп различают α-, β-, γ-аминокислоты:

α-аминопропионовая β-аминопропионовая
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. Здесь будут рассматриваться только α-аминокислоты, поскольку другие аминокислоты в природе не встречаются.
В состав белков входят 19 основных аминокислот и одна иминокислота. Все природные аминокислоты имеют тривиальные названия.
Изомерия. Во всех α-аминокислотах, кроме глицина, α-углеродный атом связан с четырьмя разными заместителями, поэтому все эти аминокислоты могут существовать в виде двух изомеров (энантиомеров), являющихся зеркальными отражениями друг друга (оптическая изомерия). Каждый изомер относят к D- или L-ряду в зависимости от того, совпадает его конфигурация с конфигурацией D-глицеринового альдегида или нет:
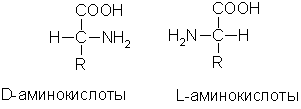
В состав белков животных организмов входят только L-аминокислоты.
Физические свойства . Аминокислоты представляют собой твердые кристаллические вещества, хорошо растворимые в воде и мало растворимые в органических растворителях. Многие аминокислоты имеют сладкий вкус.
Химические свойства . Аминокислоты - это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
Н 2 N-СН 2 -СООН + HCl→ Сl[Н 3 N-СН 2 -СООН],
Н 2 N-СН 2 -СООН + NaOH → H 2 N-CH 2 -COONa + Н 2 О.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H 2 N-CH 2 -СООН → + Н 3 N-СН 2 -СОO - .
Важнейшее свойство аминокислот - их способность к конденсации с образованием пептидов.
Качественные реакции.
1) Все аминокислоты окисляются нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтое окрашивание. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом.
2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос - желтый).
Получение . Основной способ получения аминокислот - замещение атома галогена на аминогруппу в галогензамещенных кислотах. Этот способ аналогичен получению аминов из алкилгалогенидов и аммиака. Выделяющийся при замещении галогеноводород связывают избытком аммиака:
Cl-CH(R)-COOH + 2NH 3 → H 2 N-CH(R)-COOH + NH 4 Cl.
Какие вещества называются аминокислотами?
Как классифицируются аминокислоты?
Какие физические свойства характерны аминокислотам?
Какие качественные реакции характерны для аминокислот?
Какие виды изомерии характерны для аминокислот?
Где применяются аминокислоты?
Что образуется в результате реакции поликонденсации аминокислот?
Какие способы получения аминокислот вы знаете?
Что собой представляет биполярный ион?
Лекция № 31: Понятие о гетероциклических соединениях.
Гетероциклические соединения - органические соединения, содержащие в своих молекулах циклы, в образовании которых принимают участие неуглеродные атомы (гетероатомы). Гетероциклические соединения классифицируют по числу атомов в цикле и по типу гетероатома.
Шестичленные гетероциклы
Пиридин C 5 H 5 N - простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота:

Строение. По электронному строению пиридин напоминает бензол. Все атомы углерода и атом азота находятся в состоянии sp 2 -гибридизации. Шесть электронов (по одному от каждого атома), находящихся на негибридных орбиталях, образуют p-электронную ароматическую систему. Из трех гибридных орбиталей атома азота две вступают в образование σ-связей C-N, а третья содержит неподеленную пару электронов.
Физические свойства . Пиридин - бесцветная жидкость, немного легче воды, с характерным неприятным запахом; с водой смешивается в любых отношениях.
Химические свойства пиридина определяются наличием ароматической системы и атома азота с неподеленной электронной парой.
1. Основные свойства. Пиридин - более слабое основание, чем алифатические амины (К b = 1,7 . 10 -9). Его водный раствор окрашивает лакмус в синий цвет:

При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:
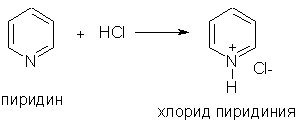
2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Пиридин нитруется при 300 °С с низким выходом:

Атом азота в реакциях электрофильного замещения ведет себя как заместитель 2-го рода, поэтому электрофильное замещение происходит в мета-положение.
В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы, и орто-пара-положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара-аминопиридинов (реакция Чичибабина):
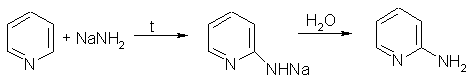
3. При гидрировании пиридина образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:

4. Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты:

Никотиновая кислота и ее амид - важные лекарственные препараты
Пиримидин C 4 H 4 N 2 - шестичленный гетероцикл с двумя атомами азота. Его можно рассматривать как аналог бензола, в котором две группы СН заменены на атомы азота:

Благодаря наличию в кольце двух электроотрицательных атомов азота пиримидин еще менее активен в реакциях электрофильного замещения, чем пиридин. Его основные свойства также выражены слабее, чем у пиридина.
Основное значение пиримидина состоит в том, что он является родоначальником класса пиримидиновых оснований.
Пиримидиновые основания - производные пиримидина, остатки которых входят в состав нуклеиновых кислот: урацил, тимин, цитозин.
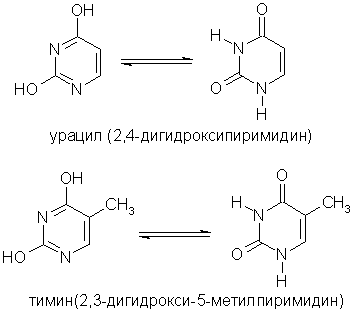
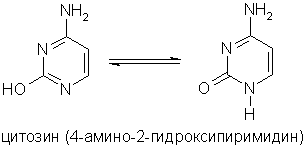
Получение . Пиридин выделяют из каменноугольной смолы, в которой его содержание 0,08%. В лабораторных условиях пиридин можно синтезировать из синильной кислоты и ацетилена:
2HC≡CH + HC≡N → C 5 H 5 N.
Вопросы для закрепления темы:
Пояснительная записка (6)
Пояснительная запискаПояснительная записка Настоящая программа предназначена для обучения...
Пояснительная записка (7)
Пояснительная запискаПОЯСНИТЕЛЬНАЯ ЗАПИСКА Лабораторная работа заключается в том, что...
Какие вещества относятся к гетероциклическим соединениям?
Как подразделяются гетероциклические соединения?
Какие химические свойства для них характерны?
Где встречаются гетероциклические соединения?
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Данная программа используется для обучения...
По своей химической природе крахмал , как и все сахара (глюкоза, сахароза и другие), а также клетчатка (целлюлоза), относится к классу углеводов . Установлено, что молекула крахмала состоит из двух составных частей - амилозы и амилопектина. В кукурузном крахмале амилоза составляет четверть всей массы вещества, а амилопектин - три четверти. В других крахмалах соотношение этих двух частей несколько иное; например, в картофельном крахмале амилоза составляет приблизительно 20%, а амилопектин - 80%. Амилоза и амилопектин отличаются друг от друга по химическому строению, но обе эти части состоят из остатков молекул глюкозы. Рассмотрим более подробно свойства крахмала.
Формула крахмала
Молекулы крахмала имеют различный размер, он не растворим в холодной воде. Имеет следующую формулу: (C 6 H 10 O 5)n.
Молекула крахмала
В целом молекула крахмала состоит примерно из шести с половиной тысяч глюкозных остатков, соединенных друг с другом. Эти остатки образуют как бы ветвистые цепочки. Таким образом, крахмал - это природный полимер. Ведь знакомое ныне всем слово «полимер» означает вещество, состоящее из многих одинаковых, сравнительно простых частиц. Таким именно веществом и является крахмал независимо от его происхождения, будь-то кукурузный или картофельный, рисовый или пшеничный. Отличаются между собой зерна крахмала только по величине и по форме.
Зерна кукурузного крахмала круглой или реже многоугольной формы. Величина их колеблется в пределах от 2 до 30 мк; чаще всего приходится иметь дело с зернами величиной 20-25 мк.
Физические свойства крахмала
Весьма любопытны физические свойства крахмала . В холодной воде он поглощает очень немного воды (25-30%) и заметно не набухает. Зато уже при температуре больше 60°С кукурузный крахмал набирает воды в 3 раза больше собственного веса. При этом происходит клейстеризация крахмала. Если температуру повысить до 70 СС, то крахмал поглощает уже около 100% воды. Максимально крахмал может набрать и удержать до 2500% воды, то есть в 25 раз больше собственного веса. Удивительная «сила» у крахмала!
До революции крахмал в нашей стране получали почти исключительно из картофеля. Производство кукурузного крахмала составляло всего только один процент от общей выработки крахмала.
Физические свойства и нахождение в природе.
1. Крахмал представляет собой белый порошок, не растворимый в воде.
2. В горячей воде он набухает и образует коллоидный раствор – клейстер.
3. Являясь продуктом усвоения оксида углерода (IV) зелеными (содержащими хлорофилл) клетками растений, крахмал распространен в растительном мире.
4. Клубни картофеля содержат около 20 % крахмала, зерна пшеницы и кукурузы – около 70 %, риса – около 80 %.
5. Крахмал – одно из важнейших питательных веществ для человека.
Строение крахмала.
1. Крахмал (С 6 H 10 O 5) n – природный полимер.
2. Образуется он в результате фотосинтетической деятельности растений при поглощении энергии солнечного излучения.
3. Сначала из углекислого газа и воды в результате ряда процессов синтезируется глюкоза, что в общем виде может быть выражено уравнением: 6СO 2 + 6Н 2 О = С 6 Н 12 O 6 + 6O 2 .
5. Макромолекулы крахмала неодинаковы по размерам: а) в них входит разное число звеньев С 6 H 10 O 5 – от нескольких сотен до нескольких тысяч, при этом неодинакова и их молекулярная масса; б) различаются они и по строению: наряду с линейными молекулами с молекулярной массой в несколько сотен тысяч имеются молекулы разветвленного строения, молекулярная масса которых достигает нескольких миллионов.
Химические свойства крахмала.
1. Одно из свойств крахмала – это способность давать синюю окраску при взаимодействии с йодом. Эту окраску легко наблюдать, если поместить каплю раствора йода на срез картофеля или ломтик белого хлеба и нагреть крахмальный клейстер с гидроксидом меди (II), будет видно образование оксида меди (I).
2. Если прокипятить крахмальный клейстер с небольшим количеством серной кислоты, нейтрализовать раствор и провести реакцию с гидроксидом меди (II), образуется характерный осадок оксида меди (I). То есть при нагревании с водой в присутствии кислоты крахмал подвергается гидролизу, при этом образуется вещество, восстанавливающее гидроксид меди (II) в оксид меди (I).
3. Процесс расщепления макромолекул крахмала водой идет постепенно. Сначала образуются промежуточные продукты с меньшей молекулярной массой, чем у крахмала, – декстрины, затем изомер сахарозы – мальтоза, конечным продуктом гидролиза является глюкоза.
4. Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученыйК. Кирхгоф. Разработанный им способ получения глюкозы используется и в настоящее время.
5. Макромолекулы крахмала состоят из остатков молекул циклической L-глюкозы.
- < Назад
- Вперёд >